I
Хлори́рование
органических соединений, процесс прямого замещения в органических соединениях атомов водорода атомами хлора. Х. может быть осуществлено действием свободного хлора или веществами, его генерирующими, например хлористым сульфурилом SO
2Cl
2 (см.
Сульфурила галогениды)
. Механизм Х. определяется природой органического соединения и условиями реакции. Так, насыщенные углеводороды взаимодействуют с хлором при облучении ультрафиолетовым светом (УФ-облучении) по радикально-цепному механизму:
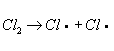
;
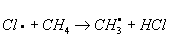
;
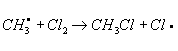
и т. д.
Эта реакция лежит в основе промышленного способа получения из метана метилхлорида, метиленхдорида, хлороформа, четырёххлористого углерода, из пентановых фракций бензина - амилхлоридов. Х. органических соединений ароматического ряда протекает по ионному механизму в присутствии кислотного катализатора, например AlCl
3 или FeCl
3. Т. о. в промышленности получают, например,
Хлорбензол:
Cl2 + FeCl3 → С+ + [FeCl4]-;
C6H6 + Cl+ → C6H5Cl + Н+;
[FeCl4]- + H+ → FeCl3 + HCl.
Принимая во внимание различия в механизмах Х. органических соединений алифатических и ароматических рядов, регулируют Х. жирно-ароматических углеводородов: прибавление FeCl3 ведёт к замещению атомов водорода в ароматическом ядре, тогда как УФ-облучение и повышение температуры способствуют Х. боковых алифатических групп. Так, в промышленности Х. толуола получают хлортолуолы (в присутствии FeCl3) или бензилхлорид C6H5CH2Cl (под действием УФ-облучения). При высокой температуре удаётся осуществить прямое замещение атомов водорода на хлор и в алкильных группах олефинов (с сохранением кратной связи), например:
Эта реакция используется в промышленности для получения
Аллилхлорида
- исходного продукта в производстве
Глицерина
. Иногда под Х. в более широком смысле понимают создание связи С-Cl любым способом, например присоединением по кратным связям хлора, хлористого водорода, хлорноватистой кислоты, хлористого нитрозила, замещением на хлор др. функциональных групп (гидроксильной в спиртах и карбоновых в кислотах, аминогруппы в ароматических аминах после предварительного их диазотирования и др.). Так, в промышленности присоединением хлора к этилену получают
Дихлорэтан, являющийся сырьём в одном из способов производства
Винилхлорида; хлорированием ацетилена -
Тетрахлорэтан, применяемый для получения
Трихлорэтилена
, хлорированием некоторых каучуков - хлор-каучуки. Реакцией ненасыщенных соединений с хлористым водородом в промышленности производят винилхлорид,
Этилхлорид, Хлоропрен. Х. используется также для получения инсектицидов (См.
Инсектициды) (гексахлорана, полихлорпинена, полихлоркамфена), гербицидов (См.
Гербициды)
, например эфиров 2,4-дихлор-феноксиуксусной кислоты,
Гексахлорэтана
(заменителя камфары (См.
Камфара)) и др. важных продуктов.
II
Хлори́рование
в цветной металлургии, технологический процесс нагрева материалов, содержащих цветные металлы, в атмосфере хлора, хлорсодержащих газов или в присутствии хлористых солей с целью извлечения и разделения цветных металлов.
В основе процесса лежит взаимодействие окислов или сульфидов металлов с хлором или хлоридом водорода по обратимым реакциям. Окислы, у которых
Гиббсова энергия этих реакций имеет большие отрицательные значения (PbO, ZnO, Ag
2O и др.), хлорируются при малых концентрациях хлора в газовой среде и в присутствии кислорода; окислы с большими положительными значениями гиббсовой энергии (SiO
2, TiO
2, Al
2O
3) практически не взаимодействуют с газообразным хлором, т.к. даже следы кислорода в газовой среде препятствуют образованию хлоридов. Х. окислов облегчается в присутствии веществ, связывающих свободный кислород и уменьшающих его концентрацию в газовой фазе, например углерода, водорода, сернистого ангидрида. Таким образом, изменяя состав газовой фазы и температуру процесса, можно подобрать условия селективного Х.; в частности, в присутствии кислорода и паров воды можно прохлорировать ряд цветных металлов, оставив в окисленной форме железо, а в восстановительной атмосфере перевести в форму хлоридов окислы железа. В качестве хлорирующих агентов, кроме элементарного хлора и HCl, применяют дешёвые соли - каменную соль (NaCl), сильвинит (KCl․2NaCl), хлорид кальция (CaCl
2) и др. При этом Х., в особенности при использовании малолетучего CaCl
2, идёт преимущественно через разложение соли парами воды с образованием HCl; разложению соли-хлоринатора способствует присутствие SO
2 или SO
2, образующих CaSO
4, CaSiO
3 и т.п.
Разновидности Х.: хлорирующий обжиг,
Хлоридовозгонка и
Сегрегация. Хлорирующий обжиг проводят при относительно низкой температуре, при которой образующиеся хлориды ещё нелетучи. Х. осуществляют в электропечах, печах кипящего слоя, трубчатых или многоподовых обжиговых печах. Процесс применяется в производстве магния для перевода окиси магния в хлорид, который затем подвергают электролизу, а также для извлечения кобальта и меди из бедных материалов, чаще всего из пиритных огарков и кобальт-никелевых штейнов; кобальт, медь, цинк переходят в форму хлоридов и выщелачиваются водой или слабой кислотой, а железо не хлорируется и остаётся в форме окислов в твёрдом остатке. Хлоридовозгонка, в отличие от хлорирующего обжига, ведётся при более высоких температурах, обеспечивающих улетучивание хлоридов металлов; процесс более универсален: позволяет извлекать больше различных цветных и редких металлов, а также золото и серебро. Сегрегация, в отличие от хлоридовозгонки, требует меньшего расхода хлоринаторов и ведётся при более низкой температуре, но для получения концентрата необходима дополнительная операция - флотация или магнитная сепарация.
Х. применяется также для рафинирования расплавленных металлов от примесей: алюминия - от натрия и кальция, свинца - от цинка, олова - от свинца. Разрабатываются процессы удаления меди и кобальта из никелевого
Файнштейна хлоридными расплавами.
Лит.: Смирнов В. И., Тихонов А. И., Обжиг медных руд и концентратов, 2 изд., М., 1966; Морозов И. С., Применение хлора в металлургии редких и цветных металлов, М., 1966; Гудима Н. В., Шейн Я. П., Краткий справочник по металлургии цветных металлов, М., 1975.
И. Д. Резник.



